
一、概述
多糖结合疫苗为荚膜多糖与载体蛋白共价结合形成的复合物,该复合物可提高细菌疫苗多糖抗原的免疫原性,如 b 型流感嗜血杆菌多糖结合疫苗、脑膜炎球菌多糖结合疫苗和肺炎球菌多糖结合疫苗等。核磁共振(Nuclear Magnetic Resonance, NMR)技术系多糖结合疫苗研发有力的分析技术手段之一,该方法一般不对样品做破坏性的化学处理,具有专属性高、准确性好、一次实验可检测多项指标的优势,可应用于多糖结合疫苗的工艺表征、质量特性研究、质量控制等,以评价多糖结合疫苗不同生产阶段中间产物的结构特性、多糖抗原表位的潜在变化及批间一致性。但 NMR 技术存在较高的分析难度,需根据不同的研究目的(糖链的解析、修饰基团的确证、杂质的分析等),选用不同的样品预处理方式、测定方式(溶液浓度调整、内标物添加等)和谱图类型(一维谱、二维谱等),同时可能涉及到复杂的谱图解析工作。随着 NMR 技术在多糖结合疫苗研发过程和上市产品中的广泛应用,出现了在检测样品处理、分析方法、检测报告、检测仪器参数性能等方面的诸多共性问题和方法学挑战,如合适的 NMR 设备选择及设备验证、产品预处理方法评估及选择、不同阶段产物特性对分析操作及结果解析的影响等。此外,不同企业对该方法的理解和使用存在较大差异,如,采用 NMR 技术开展杂质分析及结构确证研究的可实现程度及结果精准度、核磁谱图信息标注及谱图解析存在较大差异等。 药品审评中心针对上述共性问题和常见问题,结合现有产业及分析机构经验,形成 NMR 技术在多糖结合疫苗研究中基本原则和关键操作步骤的技术要点,以期进行方法学的规范和细化,建立规范的标准以推动该技术的落地、应用和实施。
本文所指的多糖特指细菌荚膜多糖。对于含脂多糖的多糖结合疫苗,可根据产品特性及其适用性予以参考本技术要点。
二、常见问题及建议
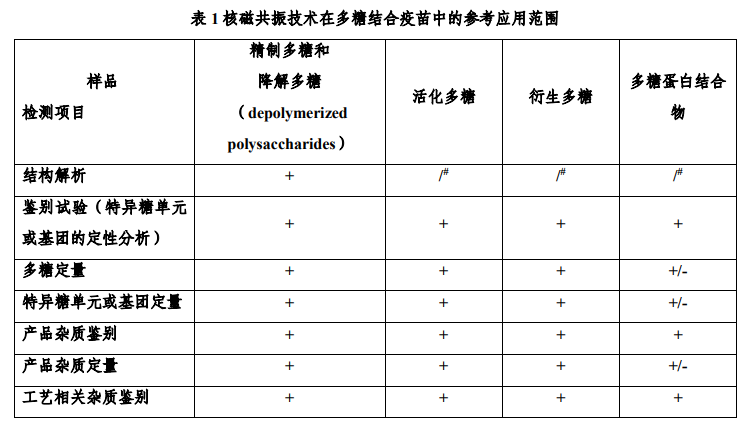
(一)核磁共振技术在多糖结合疫苗质量研究中的应用NMR 技术可用于从精制多糖到多糖蛋白结合物原液的全过程产物的表征和分析,包括结构确证、鉴别、多糖和特异基团定量、杂质残留量检测和修饰度检测等。表 1 总结了核磁共振技术在多糖结合疫苗不同生产阶段中的应用。通常采用一维氢核磁共振(1H NMR)即可满足多数检测需求,但对于结构确证和个别杂质含量分析,需结合其他方法(如碳谱、磷谱、二维谱图等)进行综合评估。NMR 技术可通过检测多糖分子中特定原子的化学位移等谱图特征实现结构确证,兼具定性和定量分析功能,如,利用特征原子的化学位移、耦合裂分和谱峰积分数值可进行多糖鉴别;利用特征原子谱峰的积分数值可进行定量分析。对于定性研究,应明确特征信号的化学位移、耦合裂分和积分数值。对于定量研究,则应明确原子的特征化学位移及其专属性,根据其特征原子间的比较进行定量,依据产品特性、检测目的综合选择定量模式,包括绝对定量和相对定量。首选单一峰进行积分定量,若单一峰无法满足定量分析方法要求,进行充分论证后,可根据谱峰归属和方法验证结果等选择多个峰予以积分定量。如果研究对象化学位移难以指认,或受其它因素干扰,可采用辅助方法予以解决。多糖结合疫苗以多糖为主要抗原成分,多糖结构是确保其抗原性、抗体特异性及功能性杀菌抗体生产的物质基础,应对其多糖结构进行充分的结构解析。由于细菌多糖抗原的生物合成受到基因调控、代谢调节和细胞信号传导等多个因素的影响,应对精制多糖 NMR 谱图中所有可分析的化学位移进行归属,“应解尽解”,并以此作为后续中间品鉴别和含量分析的依据。对于活化多糖、衍生多糖、多糖蛋白结合物的 NMR 研究,则重点关注全工艺过程不同工艺步骤对多糖分子特异糖单元或基团的影响。尽管多糖蛋白结合物中因载体蛋白的引入降低了多糖的核磁分辨率,同时样品前处理可能使部分定量分析结果与多糖蛋白结合物实际情况存在差异,但随着设备和分析方法等技术进步,采用现有 NMR 技术对多糖蛋白结合物的多糖抗原和杂质等进行定量研究具有可行性,建议结合产品特性、检测需求等,优化实验条件以尽可能将 NMR 技术应用于多糖蛋白结合物的关键质量特性分析。
此外,多糖结合疫苗部分质量特性研究及质量标准可通过 NMR 法等多种分析方法检测,如涉及,建议对不同分析方法所测结果进行比对分析。同一样品采用 NMR 法的定量结果,可能与化学显色法和离子色谱法等有一定差异,应对分析方法进行评估,确定方法适用性。

(二)核磁共振技术在多糖结合疫苗质量研究中的关注点
1.多糖结构解析
细菌多糖抗原的生物合成受到基因调控、代谢调节等多因素影响,应采用 NMR 技术对精制多糖开展充分的结构解析,归属多糖端基区、环质子区和甲基质子区等可明确分辨的谱峰化学位移。多糖结合疫苗生产工艺较为复杂、且存在破坏多糖抗原免疫表位的潜在可能,需要加强中间产物多糖抗原化学结构的监测,重点关注不同工艺阶段中间产物(降解多糖、活化多糖、衍生多糖、多糖蛋白结合物)各谱峰的化学位移等变化,以及对可能出现的新特征性原子谱峰予以指认。利用 NMR 技术开展多糖的结构解析时,原则上,建议综合应用一维核磁谱图(如氢谱、碳谱、磷谱)、二维核磁谱图(如 1H1H COSY、1H1H TOCSY、1H1H NOESY 、1H13C HSQC、1H13C HMBC、1H13C HSQC-COSY、1H13CHSQC-TOCSY 等),整合分析各谱峰的化学位移、积分数值、耦合裂分等信息,实现糖链谱图的谱峰指认和结构解析(如取代基位置、糖单元连接方式等)。但鉴于多糖结合疫苗研发与生产中所用多糖抗原通常为已知结构物质,对于谱峰较为分散的多糖,建议可结合文献报道核磁谱图,通过一维核磁谱图对比,实现多糖结构与预期结构一致性的评价;对于一维核磁谱图各谱峰较为拥挤、重叠的多糖,需根据多糖结构特点,采用合适的二维核磁谱图,尽可能实现对糖链结构的完整解析。
2.鉴别试验
NMR 技术可用于多糖及其降解物、活化多糖、衍生多糖等特异基团定性分析的鉴别试验。可根据 1H NMR 中特征信号的化学位移、耦合裂分和/或积分数值判断多糖结构特征,需明确特征性质子在多糖化学结构中的归属、相对数量及其化学位移的范围。精制多糖的鉴别试验还应该关注特征质子区是否有杂峰,并尽可能分析杂峰的归属。多糖 NMR 鉴别试验除上述对各种产物的型特异性鉴别外,还可用于生产用菌株鉴定,可通过对多糖产物进行结构鉴别以辅助菌株鉴定。尤其是采用新来源生产用菌株时,可采用 NMR 分析对多糖产物进行鉴别,以对生产用菌株的适用性予以确认。
3.多糖含量检测
通常可采用 1H qNMR(Quantitative 1H NMR,定量核磁共振氢谱)进行多糖含量分析,如采用 31P NMR或 13C NMR,需关注多糖结构和分子大小、方法可行性、信噪比等因素对结果准确性的影响。在进行含量检测时,应选择化学位移受其它信号干扰较小的质子,一般首选端基质子,如端基质子不可用,则可以考虑其它含量稳定的、专属性强的特征性质子。如多糖含有不完全修饰残基(如部分 O-乙酰化),应分别对多糖链和残基定量,采用适宜方式计算得出总多糖含量。
4.特异糖单元或特异基团含量检测
在化学位移明确且不受干扰的前提下,多糖常见的特异基团或特异糖含量均可采用 1H qNMR 法定量,包括唾液酸、O-乙酰基、糖醛酸、氨基己糖、甲基戊糖、丙酮酸等,具体情况需结合多糖结构进行分析。部分特异基团分析可能存在挑战,如磷酸甘油特征谱峰与多糖谱峰信号重叠,导致 1H qNMR 法难以利用独立定量峰对磷酸甘油进行定量。如采用其他方法(如定量 31PNMR 法等),需提供合理性依据。
5.多糖修饰度检测
对于活化多糖和衍生多糖,应该关注经修饰后多糖的特异基团含量。通常情况下,如果活化、衍生位点所含的氢质子信号满足用于积分定量的前提要求,则可使用该积分定量对活化率、衍生率进行定量分析。
6.产品相关杂质鉴别和定量
NMR 技术可用于检测产品相关杂质,其更多应用于精制多糖产品相关杂质研究。由于精制多糖多提取自细菌发酵产物,而细菌细胞壁含有多种形式的多糖,部分杂质多糖可能残留在产品中,应根据风险评估结果进行定量分析,尽可能对杂质多糖特征谱峰进行指认。如C多糖为肺炎球菌的细胞壁多糖,由于其分子大小与荚膜多糖类似,在纯化过程中存在挑战,而残留的 C多糖对多糖结合疫苗免疫原性存在潜在影响。C 多糖特征性原子化学位移明确,需采用适宜方法对磷酸胆碱(如,31P NMR)取代基数量进行定性鉴别后,再采用 1H qNMR 等进行定量分析,并需对该方法的灵敏度予以重点关注。同时,对于含磷肺炎球菌多糖中的 C多糖,需关注磷谱的解析,如无法确定磷酸胆碱取代基数量,应以单取代计算 C 多糖含量。
7.工艺相关杂质鉴别和定量
生产过程中引入的试剂,如十六烷基三甲基溴化铵(Hexadecyl trimethyl ammonium bromide,CTAB)、乙醇等,可能在 1H NMR 谱图上呈明显的谱峰,这些物质在一定含量范围可被检测。衍生过程中添加的连接子,在结合和游离状态下的特征化学位移若有差异,可利用 NMR 测定游离态连接子残留量。对于一维 NMR 检测无法确定的杂质,鼓励采用二维 NMR 进行研究。
(三)核磁共振技术方法学
一般流程:
1.仪器设备及参数设定
应根据检测目的选择和优化检测参数,其中核磁共振谱仪的场强是重要的影响参数,通常越高的场强意味着更高的灵敏度,有助于减少采集时间。对于定量分析实验,可尝试通过适当增加样品浓度、实验扫描次数等方法增强信号,一般情况下推荐 600 MHz 及以上的 NMR 谱仪。不同多糖及同一多糖不同中间产物的化学结构、溶解性质均存在较大差异,将对 NMR 信号强度产生影响。因此,需要对各种不同性质的多糖抗原开展具有针对性的实验参数优化,以获得最佳的 NMR 谱图采集效果,通常可对检测温度、弛豫延迟时间、扫描次数等参数开展优化。另外,对于黏度较高的多糖,可考虑提高检测温度或其他适宜方法以降低样品黏度。核磁共振谱仪应定期进行仪器性能确认,确认内容包括检测温度校正、线型(lineshape)、分辨率以及信噪比等。
2.内标物的选择依据
内标是核磁共振谱图分析的重要依据。在进行定量NMR 实验时,通常通过比较样品和内标特征峰的积分面积完成定量,因此内标的选择会对结果准确性产生较大影响。在选定内标时,需要注意以下几点:1.内标应当易于称量、易溶于所选用的氘代试剂,化学性质稳定且不与待测物发生反应;2.内标应结构简单,在核磁氢谱中最好具有单一谱峰,且该谱峰应具有较高强度、适宜的峰宽;3.内标谱峰和待测物质谱峰基线分离;4.内标物质量值应可溯源。
3.核磁共振技术样品及样品关注点
应根据实验目的等选择适宜的样品检测状态(液体、冻干),同时应对目标检测物取样的可行性、冻干的可行性、溶解性和溶解后的稳定性等予以评估。对于定量实验分析通常建议采用冻干样品。多糖普遍具有较好的水溶性,NMR 样品检测液的溶剂通常选用同位素氘纯度大于 99%的重水,而不同多糖的溶解性存在差异,为了提高 NMR 谱图信号的强度,需尽可能提高多糖检测液的浓度。但随着多糖浓度提高,检测液黏度也随之提高,不仅增加了样品配制的操作难度,还将降低谱图的分辨率,导致各个谱峰的积分值存在较大误差,尤其对于定量核磁实验的开展造成不利影响。因此需根据样品自身的溶解特点及方法验证数据确定适宜浓度范围,通常情况下,多糖核磁检测液推荐浓度范围为 1-5 mg/mL。
此外,由于多糖水溶液黏度相对较大,制样中易产生气泡影响谱图质量,样品在加入核磁管前可通过适宜手段,如室温短时间离心、超声等手段去除溶液中的气泡,以提高核磁谱图质量。对于多糖抗原的结构解析和鉴别试验,通常在制备样品时将一定质量充分干燥的多糖溶解于氘代试剂(一般为重水或重水配制的缓冲液)中即可,要注意该检测液中应包含化学位移定标的参考物质(如 TSP-d4 或 DSS-d6)。对于多糖抗原含量的定量分析,应称定待检多糖,并精密量取含一定浓度内标物的氘代试剂溶解多糖,给予充分溶解时间以保证多糖的完全溶解。多糖的水分含量对谱图质量及定量准确性存在潜在影响,称量过程中应控制环境湿度,防止多糖吸潮。为保证称量准确性,一次称量多糖的重量建议不低于 10mg,多糖溶液浓度具体视多糖结构、溶解度和多糖溶液黏度而定。除上述不同分析目的中对样品处理方式的关注点外,还需关注不同预处理方式对产物分析结果可能产生的影响,具体如下:样品冻干过程可能会去除易挥发杂质,应采用适宜的方法对冻干前后杂质的残留情况予以确认。结合物原液检测前如需进行浓缩、脱盐或在特殊溶液中检测,还应考虑上述步骤及情况是否改变结合物分子的溶解性和关键质量属性,并判断是否会对实验结果产生影响。
4.核磁共振谱图处理和分析建议
待测样品经预处理、制样、上样和核磁共振谱图采集后,需对各谱图进行相应处理,包括傅立叶变换、相位校正和基线校正等步骤,可根据测试目的(定性或定量分析)设置其它相关参数,以内标物的谱峰为参考峰确定待测物谱峰的化学位移。在谱图处理中需根据谱图质量(如灵敏度和分辨率)和实验目的(如定性和定量分析)调整优化相关参数。对于一维谱图,根据需要调整参数 LB(linebroadening);对于二维谱图,根据需要调整充零(ZF,zero filling)和线性预测(LP,linear prediction)参数。一维氢谱的分析应至少包括谱峰的指认、谱峰的定性和/或定量。对已有文献谱图可供参考的多糖,其谱峰归属一般参考文献结果完成,对谱图进行标峰或积分处理,可进行多糖定性或定量检测。对于一维氢谱较为复杂且暂无可参考文献的多糖,建议结合二维谱图或其它检测方法进行解析和谱峰的指认。谱图解析可优先指认氢(1H)化学位移,通常结合一维 1H谱和二维 1H1H COSY、TOCSY、NOESY 谱图获得较完全的指认;对于碳(13C)化学位移,一般可通过一维 13C和二维 1H13C HSQC、HMBC 进行指认;对于磷(31P)化学位移,通常通过一维 31P 和二维 1H31P 谱图进行指认。
5.质量标准的制定与方法验证要求
鼓励将 NMR 分析方法纳入放行质量标准,质量标准的制定可参照《中华人民共和国药典》、ICH Q6B、ICH Q2(R2)和国内外相关指导原则等,根据产品特点对生产工艺、各阶段质量研究数据、批次放行检测结果及稳定性研究结果进行综合考虑。对于 NMR 用于不同检测项目标准限度的设定,应依据分析目的及工艺性能等进行不同的侧重考虑。对于多糖鉴别试验,可根据特征质子的化学位移、耦合裂分和积分数值等进行定性判断。对于特异糖单元和特异基团含量检测的质量标准,应根据分析方法、产品特性及检测项目实测值进行设定。对于修饰度,除实测值外,应综合工艺目的考虑设定。对于杂质应根据残留限度和工艺性能等设定。对于放行检测的核磁分析应结合检测目的并参照国内外相关指南要求开展相应的验证。对于结构解析等定性分析方法,应当进行专属性和耐用性验证,专属性应考虑特征性原子化学位移的指认;对于定量分析,应当进行专属性、线性、准确度、精密度、耐用性等方面的验证,并具有可接受的信噪比;对于杂质等残留量测定类方法,除上述定量分析所需的验证外,还需增加定量限和检出限的考察。在专属性方面,除了考虑特征性原子化学位移的指认,还应该考察该化学位移是否受其它信号的干扰。
(四)检测报告
核磁共振检测报告应符合检测报告的一般要求,需能体现完整的谱图分析过程。对于定量分析,应提供完整的计算过程。包含但不限于以下几个方面的内容:
(1)设备信息:应包括核磁共振波谱仪的型号、场强、探头型号等信息。
(2)测试参数:应包括脉冲程序、脉冲角度、扫描次数、弛豫延迟时间、谱宽、采集点数、检测温度等。
(3)供试品配制:应提供氘代试剂及内标物质的名称、纯度、批号,内标和样品称量、样品溶解及稀释过程。
(4)结果分析:应针对谱图分析制定标准化流程和参数,以避免人为随机操作带来的误差。对于定性分析,测试结果部分应至少包含氢谱,鼓励提供二维谱图,对于含磷多糖鼓励提供磷谱;应标注多糖特征谱峰化学位移,并提供对各个特征谱峰的归属、特征谱峰与规定化学位移或参比谱图一致的说明。参比谱图应采用经验证的方法、代表性批次产品得出。
对于定量分析,测试结果部分应至少包括定量内标浓度、用于定量的内标特征谱峰归属及原子数、用于定量原子的特征谱峰的归属及该谱峰对应原子数、积分范围及积分面积、用于定量的特征谱峰的信噪比。应提供标注有定量特征峰化学位移及积分面积、内标积分面积的原始谱图。结果计算部分,应提供明确的计算公式及根据公式得出结果的计算过程。
三、参考文献
[1]国家药典委员会.中华人民共和国药典[S].2025 版.北京:中国医药科技出版社,2025.
[2]国家药品监督管理局.《多糖结合疫苗药学研究及评价技 术 指 导 原 则 . [EB/OL]. 2024 年 12 月 .
https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=7640fd523471b2e237ca2d0e1ffd5983.
[3]United States Pharmacopeial Convention. USP38-NF35,<1234> Vaccines for human use-Polysaccharide andglycoconjugate vaccines [S], Rockville, MD: Unite StatesPharmacopeial Convention, 2017.
[4]United States Pharmacopeial Convention. USP-NF,<761>nuclear magnetic resonance spectroscopy [S],Rockville, MD: Unite States Pharmacopeial Convention,2020.
[5]World Health Organization. WHO Expert Committee on Biological Standardization (55th report: WHO TRSNO.924 (A2): 2004) Recommendations for the production and control of meningococcal group C conjugate vaccines.Geneva: World Health Organization; 2004.
[6]World Health Organization. WHO Expert Committee onBiological Standardization (51st WHO TRS NO.897 (A1):2000) Recommendations for the production and control of Haemophilus influenzae type b conjugate vaccines.Geneva: World Health Organization; 2000.
[7]World Health Organization. WHO Expert Committee on Biological Standardization (57th report: WHO TRS NO.962 (A2): 2006) Recommendations to assure the quality, safety and efficacy of group A meningococcal conjugate vaccines. Geneva: World Health Organization;2006.
[8]World Health Organization. WHO Expert Committee on Biological Standardization (60th report: WHO TRS NO.927 (A2): 2009) Recommendations to assure the quality, safety and efficacy of pneumococcal conjugate vaccines. Geneva: World Health Organization; 2009.
[9]International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH).ICH harmonised guideline validation of analytical procedures Q2(R2). 2023.
来源:CDE
原文下载:![]() 多糖结合疫苗核磁共振研究的技术考虑(试行).pdf
多糖结合疫苗核磁共振研究的技术考虑(试行).pdf

 冀公网安备 13010802000997号
冀公网安备 13010802000997号 微信扫一扫
微信扫一扫